




本公司所有產品僅供科學實驗,不做其他科學實驗外的使用!
產品名稱 | 人髂動脈內皮細胞 | 組織來源 | 髂動脈 |
規格 | 5×10?Cells/T25培養瓶 | 包裝 | T25培養瓶 |
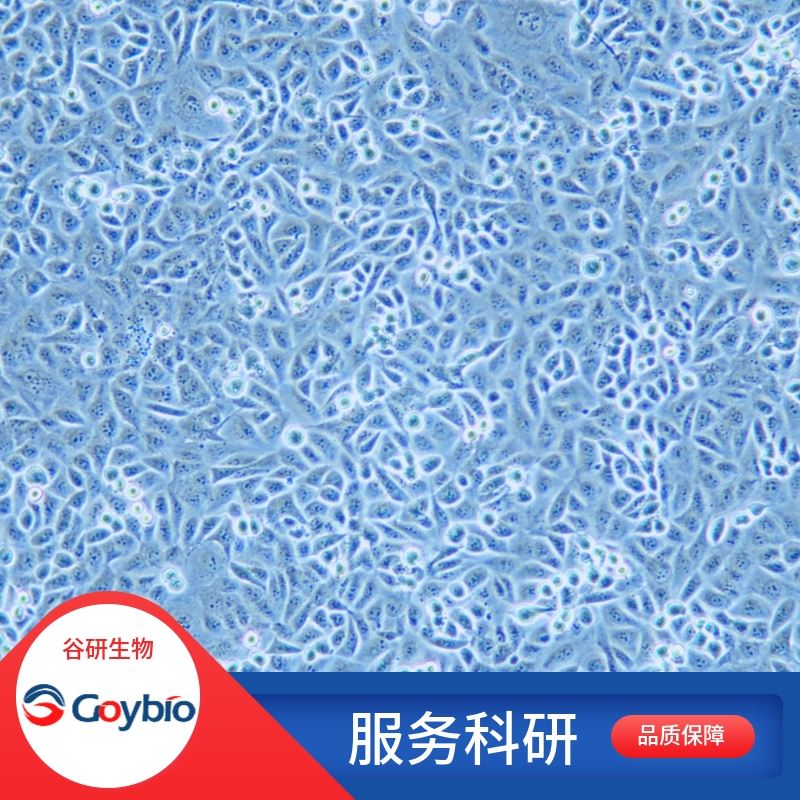
貨號 | GOY-01X0989 | 細胞形態 | 內皮細胞樣 |

人髂動脈內皮分離自髂動脈組織;髂總動脈位于人體的盆腔,人的髂總動脈有兩條,也就是臨床上左右兩條分支,它是由腹部最主要的動脈演化而來,由腹部的腹主動脈沿著人體的脊柱方向向下進行,到達第4腰椎后開始分成兩支,這就是左右髂總動脈。動脈是介于心室與毛細血管之間的管道,它接近心室的部分,管徑大,管壁較厚。經過反復分支,管徑逐漸變小,管壁變薄,最后形成與毛細血管構造相似的毛細血管前小動脈,與毛細血管相接。動脈的管徑大小和管壁的厚薄,雖相差很大,但構造上均有共同之處。一般均由3層膜組成,最內層稱為內膜,由內皮及縱行排列的結締組織構成;中間的一層稱為中膜,由環形排列的組織構成;最外的一層叫外膜,由縱行排列的結締組織構成。動脈內皮細胞是覆蓋在主動脈內面的單層細胞,可分泌一系列血管活性物質而保持血管穩態,當其受到炎癥或其它因素刺激后穩態被破壞而導致一些心血管疾病的發生。因此,動脈內皮細胞已成為研究心血管疾病發病機制及治療藥物的工具。內皮細胞或血管內皮是一薄層的專門上皮細胞,由一層扁平細胞所組成。它形成血管的內壁,是血管管腔內血液及其他血管壁(單層鱗狀上皮)的接口。內皮細胞是沿著整個循環系統,由心臟直至最小的微血管。
方法簡介:
公司實驗室分離的人髂動脈內皮采用yi蛋白酶-膠原酶聯合消化法結合差速貼壁法、并通過內皮細胞專用培養基培養篩選制備而來,細胞總量約為5×10?cells/瓶。
質量檢測:
公司實驗室分離的人髂動脈內皮經CD31免疫熒光鑒定,純度可達90%以上,且不含有HIV-1、HBV、HCV、支原體、細菌、酵母和真菌等。


包被條件 PLL(0.1mg/ml),明膠(0.1%)
培養基 含FBS、生長添加劑、Penicillin、Streptomycin等
換液頻率 每2-3天換液一次
生長特性 貼壁
細胞形態 內皮細胞樣
傳代特性 可傳2-3代
消化液 0.25%yi蛋白酶
培養條件 氣相:空氣,95%;CO2,5%
![]()
準備工作
1. 實驗器材準備:準備無菌的培養皿、培養瓶、移液管、離心管、手術器械等,并進行高壓滅菌或其他合適的消毒處理。
2. 試劑準備:配制或購買合適的培養基、消化酶(如、膠原酶等)、胎牛血清、雙抗等試劑,確保其無菌且在有效期內。
3. 實驗動物或組織來源準備:根據實驗需求,選擇合適的動物并進行相應的麻醉或處死,獲取所需組織;或從已有的組織樣本庫中獲取組織。
取材與處理
1. 取材:在無菌條件下,迅速取出目標組織,盡量減少對組織的損傷,并去除多余的脂肪、結締組織等非目的組織。
2. 清洗:將取出的組織用預冷的無菌PBS沖洗數次,以去除血液和雜質。
3. 剪切:將組織剪成約1 - 2mm3的小塊,以便后續消化。
細胞分離
1. 消化:將剪碎的組織塊放入含有適量消化酶的離心管中,在37℃恒溫搖床或培養箱中消化一段時間。期間可輕輕搖晃離心管,使消化更均勻。
2. 終止消化:當組織塊大部分被消化成單細胞懸液或小細胞團時,加入含血清的培養基終止消化。
3. 過濾與離心:用細胞篩過濾細胞懸液,去除未消化的組織碎片,然后將濾液以適當的轉速離心,收集細胞沉淀。
細胞觀察與檢測
1. 日常觀察:每天用倒置顯微鏡觀察細胞的形態、生長狀態、密度等,記錄細胞的變化情況,如發現細胞污染或異常,及時采取相應措施。
2. 細胞計數與活力檢測:在需要時,可采用臺盼藍染色等方法對細胞進行計數和活力檢測,以了解細胞的生長情況和健康狀態。


人冠狀動脈平滑肌細胞 | 人前列腺增生細胞 |
豬睪丸間質細胞 | 1,8-二羥基蒽醌 |
人永生化肝細胞 | 龍膽 |
正常人結腸成纖維細胞 | 丁香醛 |
小鼠小腦細胞 | 3,4-二羥基苯乙 |
正常星形膠質細胞 | 藜蘆 |
鼠腦毛細血管內皮細胞 | β,β'-二甲基丙烯酰阿卡寧 |
LEC-1倉鼠卵巢細胞專用培養基 | N'N-二甲基蝙蝠葛堿碘化物 |
人卵巢上皮細胞癌細胞 | 乙酰蝙蝠葛蘇林堿 |
人套細胞淋巴瘤 | 光翠雀堿 |
恒河猴腎細胞 | 海藻多糖 |
人漿細胞白血病細胞 | 三七 |
兔眼Tenon's囊成纖維細胞 | 人髂動脈內皮細胞L-鳥氨鹽鹽 |
小鼠胚胎成纖維細胞(來自NIH3T3) | D-生物 |
GoldView II型核染色劑(5000×) | QuickCut快速限制性內切酶Agel |

一、取材與分離
1. 快速操作
- 組織取材后需立即處理,避免長時間暴露于室溫或非營養環境。
- 使用無菌 PBS 或生理鹽水沖洗組織,去除血液、雜質。
2. 消化酶選擇
- 根據組織類型選擇消化酶,避免過度消化導致細胞損傷。
- 消化時間需嚴格控制(通常 10-30 分鐘),可通過顯微鏡觀察細胞解離狀態。
二、培養條件優化
1. 培養基選擇
- 使用含血清或特定生長因子的培養基(如 DMEM、RPMI 1640 等),部分細胞需添加胰島素、EGF 等。
- 避免頻繁更換培養基品牌或批次,減少細胞適應壓力。
2. 貼壁與傳代
- 原代細胞貼壁能力較弱,可能需要包被培養皿(如膠原蛋白、多聚賴氨酸)。
- 傳代時密度建議控制在 70%-80%,過度匯合會導致接觸抑制和分化。
三、污染控制
1. 無菌操作
- 全程在超凈臺操作,使用一次性耗材,避免交叉污染。
- 培養基中可添加雙抗,但長期使用可能影響細胞活性。
2. 支原體檢測
- 定期檢測支原體污染(如 PCR 法),污染后需及時丟棄細胞。
四、狀態監控
1. 日常觀察
- 每天檢查細胞形態、密度及培養基顏色,及時更換培養基(通常每 2-3 天換液一次)。
- 異常形態(如細胞變圓、碎片增多)可能提示污染或營養不足。
2. 傳代與凍存
- 原代細胞分裂次數有限(一般 5-10 代),需及時凍存早期代次細胞。
- 凍存液建議使用 DMSO+血清(或專用凍存培養基),梯度降溫后液氮保存。