




本公司所有產品僅供科學實驗,不做其他科學實驗外的使用!
產品名稱 | 大鼠皮層神經元細胞 | 組織來源 | 腦組織 |
規格 | 5×10?Cells/T25培養瓶 | 包裝 | T25培養瓶 |
貨號 | GOY-01X1025 | 細胞形態 | 神經元細胞樣 |

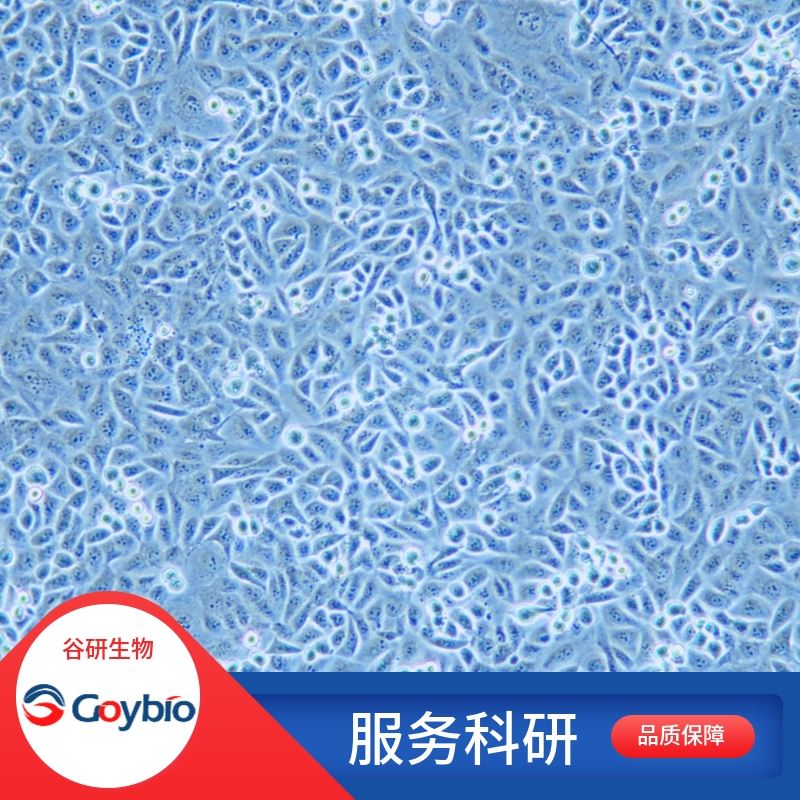
大鼠皮層神經元分離自腦皮層組織;皮層神經元細胞是構成中樞神經系統結構和功能的基本單位。神經元是具有長突觸(軸突)的細胞,它由細胞體和細胞突起構成。在長的軸突上套有一層鞘,組成神經纖維,它的末端的細小分支叫做神經末梢。細胞體位于腦、脊髓和神經節中,細胞突起可延伸至全身各器官和組織中。細胞體是細胞含核的部分,其形狀大小有很大差別,直徑約4-120微米。核大而圓,位于細胞中央,染色質少,核仁明顯。細胞質內有斑塊狀的核外染色質,還有許多神經元纖維。細胞突起是由細胞體延伸出來的細長部分,又可分為樹突和軸突。每個神經元可以有一或多個樹突,可以接受刺激并將興奮傳入細胞體。每個神經元只有一個軸突,可以把興奮從胞體傳送到另一個神經元或其他組織,如肌肉或腺體。皮質神經元是大腦皮質的主要組成細胞之一,是大腦進行功能活動調節的基本單位,參與動物多種中樞神經系統疾病的病理過程。通過形態學觀察顯示神經元從貼壁、伸出突起開始;突起逐漸增多,而后突起進一步增多并逐漸成網,同時細胞胞體增大,周邊光暈明顯。10-12d細胞最為豐滿,隨后神經元開始裂解,突起逐漸減少,細胞已退化變性,輪廓模糊,光暈消失,細胞變形。
方法簡介:
公司實驗室分離的大鼠皮層神經元采用yi蛋白酶消化法、神經元專用培養基培養篩選結合化學試劑抑制法制備而來,細胞總量約為5×10?cells/瓶。
質量檢測:
公司實驗室分離的大鼠皮層神經元經β-Tubulin免疫熒光鑒定,純度可達90%以上,且不含有HIV-1、HBV、HCV、支原體、細菌、酵母和真菌等。


包被條件 PLL(0.1mg/ml)
培養基 含B-27 Supplement、Penicillin、Streptomycin等
換液頻率 每2-3天換液一次
生長特性 貼壁
細胞形態 神經元細胞樣
傳代特性 屬于終末分化細胞;屬于不增殖細胞群
消化液 0.25%yi蛋白酶
培養條件 氣相:空氣,95%;CO2,5%
![]()
準備工作
1. 實驗器材準備:準備無菌的培養皿、培養瓶、移液管、離心管、手術器械等,并進行高壓滅菌或其他合適的消毒處理。
2. 試劑準備:配制或購買合適的培養基、消化酶(如、膠原酶等)、胎牛血清、雙抗等試劑,確保其無菌且在有效期內。
3. 實驗動物或組織來源準備:根據實驗需求,選擇合適的動物并進行相應的麻醉或處死,獲取所需組織;或從已有的組織樣本庫中獲取組織。
取材與處理
1. 取材:在無菌條件下,迅速取出目標組織,盡量減少對組織的損傷,并去除多余的脂肪、結締組織等非目的組織。
2. 清洗:將取出的組織用預冷的無菌PBS沖洗數次,以去除血液和雜質。
3. 剪切:將組織剪成約1 - 2mm3的小塊,以便后續消化。
細胞分離
1. 消化:將剪碎的組織塊放入含有適量消化酶的離心管中,在37℃恒溫搖床或培養箱中消化一段時間。期間可輕輕搖晃離心管,使消化更均勻。
2. 終止消化:當組織塊大部分被消化成單細胞懸液或小細胞團時,加入含血清的培養基終止消化。
3. 過濾與離心:用細胞篩過濾細胞懸液,去除未消化的組織碎片,然后將濾液以適當的轉速離心,收集細胞沉淀。
細胞觀察與檢測
1. 日常觀察:每天用倒置顯微鏡觀察細胞的形態、生長狀態、密度等,記錄細胞的變化情況,如發現細胞污染或異常,及時采取相應措施。
2. 細胞計數與活力檢測:在需要時,可采用臺盼藍染色等方法對細胞進行計數和活力檢測,以了解細胞的生長情況和健康狀態。


小鼠雜交瘤細胞株;4-F10 | 人正常肝細胞苯并芘轉化細胞系;HL-7702BaPT |
一種產生抗羅非魚無乳鏈球菌的單克隆抗體的雜交瘤細胞株;3A9 | SO2水溶液 |
曲妥珠(赫塞汀)耐藥的人乳腺癌細胞;BT-474/HR | Weigert碘液(1%) |
人肝癌細胞株;Huh-7/M8 | 亞鐵化鉀溶液(0.1mol/L) |
小鼠雜交瘤細胞株;2B11 | 硫亞鐵溶液(1%) |
小鼠雜交瘤細胞株;PP65 | 蔗糖-PFA溶液(30%) |
人肝癌細胞株;Huh-7/F24 | 蔗糖-PFA溶液(20%) |
人肺巨細胞癌細胞;PLA-801D | 蔗糖-PFA溶液(10%) |
小鼠雜交瘤細胞株;FlounderIgM-H | 氨基黑10B染色液(0.1%) |
小鼠雜交瘤細胞株;IE1 | 鉛鹽染色試劑盒(玫棕法) |
人白血病HL-60細胞耐藥細胞株;HL-60/RS | 鐵水溶液(0.1mol/L) |
小鼠雜交瘤細胞株;1E4 | 性品紅胺飽和溶液 |
小鼠雜交瘤細胞株;4E3 | 大鼠皮層神經元細胞氨溶液(0.1%) |
小鼠雜交瘤細胞株;11B10 | 硫鋁水溶液(2%) |
二甲雙酮 | Thomas磷鉬蘇木染色試劑盒 |

一、取材與分離
1. 快速操作
- 組織取材后需立即處理,避免長時間暴露于室溫或非營養環境。
- 使用無菌 PBS 或生理鹽水沖洗組織,去除血液、雜質。
2. 消化酶選擇
- 根據組織類型選擇消化酶,避免過度消化導致細胞損傷。
- 消化時間需嚴格控制(通常 10-30 分鐘),可通過顯微鏡觀察細胞解離狀態。
二、培養條件優化
1. 培養基選擇
- 使用含血清或特定生長因子的培養基(如 DMEM、RPMI 1640 等),部分細胞需添加胰島素、EGF 等。
- 避免頻繁更換培養基品牌或批次,減少細胞適應壓力。
2. 貼壁與傳代
- 原代細胞貼壁能力較弱,可能需要包被培養皿(如膠原蛋白、多聚賴氨酸)。
- 傳代時密度建議控制在 70%-80%,過度匯合會導致接觸抑制和分化。
三、污染控制
1. 無菌操作
- 全程在超凈臺操作,使用一次性耗材,避免交叉污染。
- 培養基中可添加雙抗,但長期使用可能影響細胞活性。
2. 支原體檢測
- 定期檢測支原體污染(如 PCR 法),污染后需及時丟棄細胞。
四、狀態監控
1. 日常觀察
- 每天檢查細胞形態、密度及培養基顏色,及時更換培養基(通常每 2-3 天換液一次)。
- 異常形態(如細胞變圓、碎片增多)可能提示污染或營養不足。
2. 傳代與凍存
- 原代細胞分裂次數有限(一般 5-10 代),需及時凍存早期代次細胞。
- 凍存液建議使用 DMSO+血清(或專用凍存培養基),梯度降溫后液氮保存。